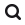RESPUESTA INMUNE E INFLAMATORIA EN EL ENVEJECIMIENTO
Seila Lorenzo-Herrero1,2,3, Christian Sordo-Bahamonde1,2,3 y Segundo González1,2,3,*
1 Departamento de Biología Funcional, Inmunología, Universidad de Oviedo, 33006 Oviedo, Spain
2 Instituto Universitario de Oncología del Principado de Asturias (IUOPA), 33006 Oviedo, Spain
3 Instituto de Investigación Sanitaria del Principado de Asturias (ISPA), 33011 Oviedo, Spain
* Autor de correspondencia: Segundo González Rodríguez, segundog@uniovi.es
Abstract
La inmunosenescencia designa el deterioro del sistema inmunitario provocado por el envejecimiento. Dicho proceso afecta a todos los elementos de la respuesta inmunitaria, alterando la defensa frente a infecciones, así como el desarrollo de memoria inmunológica asociada a la vacunación. Una de las características esenciales de la inmunosenescencia es la reducción del número y variabilidad de los linfocitos T vírgenes, especialmente los CD8, debido a la involución tímica, la disminución de la linfopoyesis y la interacción con patógenos que va incrementando el número de linfocitos T de memoria oligoclonales específicos de estos microrganismos. Las infecciones por virus latentes, como el citomegalovirus (CMV), aceleran enormemente este proceso. La reducción de linfocitos T vírgenes dificulta la respuesta a nuevos patógenos, como el SARS-CoV-2. Asimismo, aumenta la susceptibilidad a las infecciones, especialmente a partir de la 7ª-8ª década de la vida, promueve la reactivación de infecciones por virus latentes, decae la eficacia de la vacunación y favorece el desarrollo de diversas patologías, como el cáncer o algunas enfermedades autoinmunes. La inmunidad innata decae menos que la adaptativa, no obstante, otra de las características esenciales de la inmunosenescencia es la generación de una inflamación sostenida en ausencia de infecciones agudas. La inflamación crónica en los ancianos se asocia a la fragilidad, la osteopenia y la sarcopenia, y actúa como acelerador de muchas patologías crónicas asociadas al envejecimiento como las enfermedades cardiovasculares o neurodegenerativas. Mejorar la respuesta a las vacunas, la restricción calórica o el ejercicio son intervenciones útiles para atenuar o retrasar la inmunosenescencia.
Introducción
El sistema inmunitario está formado por dos componentes que trabajan coordinadamente para protegernos de los patógenos -la inmunidad innata y la inmunidad adaptativa- 1. La inmunidad innata (nacemos con ella) es capaz de combatir la infección desde el inicio, pero es inespecífica ya que no identifica patógenos concretos, sino que reconoce moléculas conservadas en familias de patógenos, denominadas Patrones Moleculares Asociados a Patógenos (PAMP). Las células inmunitarias innatas tienen receptores para PAMP que les permiten reconocer y fagocitar a la mayoría de los microbios. Si la respuesta innata es incapaz de eliminar a todos los patógenos se desencadena la inflamación, respuesta que recluta células inmunitarias adicionales al foco infeccioso, dificulta la invasión del patógeno y favorece la reparación de los tejidos dañados. Este proceso se inicia por el daño celular o tisular (traumatismos, hemorragias, etc.) o lo inicia la propia respuesta innata. Los macrófagos, por ejemplo, además de fagocitar al patógeno, secretan mediadores lipídicos (como prostaglandinas o leucotrienos) y citocinas (como TNF-α, IL-1 o IL-6) que causan inflamación. En una infección bacteriana o fúngica se reclutan, sobre todo, neutrófilos, que cuentan con los mismos receptores que los macrófagos y les ayudan a fagocitar a los patógenos. En una infección vírica se reclutan, sin embargo, células NK (del inglés Natural Killer), que son células citotóxicas capaces de eliminar aquellas células infectadas por el virus.
La inmunidad adaptativa o adquirida está mediada por los linfocitos1. Los linfocitos B reconocen patógenos extracelulares o sus moléculas, que llamamos antígenos (Ag), gracias a su receptor denominado inmunoglobulina (Ig). En la medula ósea, se genera por azar un repertorio casi ilimitado de linfocitos B, que denominamos vírgenes (1012 especificidades diferentes), cada uno de los cuales expresa una Ig diferente, pudiendo así reconocer una amplia variedad de Ag. No obstante, tal variabilidad de linfocitos B genera un problema ya que hay muy pocos específicos para cada Ag, por lo que los linfocitos deben proliferar durante, al menos, una semana para poder eliminar al patógeno tras la inducción de la respuesta adaptativa. Después de proliferar, los linfocitos B se transforman en células plasmáticas que secretan la forma soluble de su Ig de membrana o anticuerpo (Ac), el cuál favorecerá la eliminación del patógeno. Una parte de estos linfocitos que proliferan permanecen en nuestro organismo como linfocitos B de memoria, más abundantes y eficaces que los vírgenes, que nos protegerán de infecciones futuras por ese microbio. Esta memoria inmunológica es una de las características que diferencia la respuesta adaptativa de la innata y constituye la base de la vacunación.
Los patógenos intracelulares, como los virus, no pueden ser reconocidos y eliminados dentro de nuestras células por los Ac. Por ello, a lo largo de la evolución se ha generado otro tipo de linfocitos, denominados T, que están especializados en reconocer Ag intracelulares a través de su receptor TCR (del inglés T Cell Receptor). El TCR reconoce péptidos derivados de las proteínas intracelulares que son presentados por las moléculas del Complejo Mayor de Histocompatibilidad (MHC) expresadas por nuestras células. El timo es el lugar donde maduran los linfocitos T, y en él se forma por azar un repertorio casi ilimitado de linfocitos T vírgenes diferentes (1017), cada uno de los cuales expresa un TCR diferente, permitiendo el reconocimiento de péptidos intracelulares extraños (por ejemplo, derivados de un virus). Los linfocitos T vírgenes se activan cuando reconocen un péptido presentado por una célula presentadora de antígeno y se dividen durante, al menos, una semana para generar un número suficiente de linfocitos, los cuales van a eliminar al patógeno o a las células infectadas. Algunos linfocitos T que proliferan también permanecen en nuestro organismo durante largo tiempo (incluso toda la vida) como linfocitos T de memoria (10-100 veces más numerosos que los vírgenes y más eficaces) que nos van a proteger de infecciones futuras por ese microbio.
Los linfocitos T pueden dividirse en dos grandes grupos según expresen las moléculas CD4 o CD8, cada uno de los cuales se encarga de una respuesta específica para un tipo diferente de patógeno. Los linfocitos T CD8 o citotóxicos eliminan las células infectadas con patógenos intracelulares, fundamentalmente virus. Sin embargo, los linfocitos T CD4, también denominados helper o cooperadores, colaboran con otros tipos de células inmunitarias para eliminar diferentes tipos de patógenos. Dentro de ellos, los linfocitos Th1 coordinan la respuesta contra patógenos intracelulares, los Th2 contra los helmintos y los Th17 contra micro-patógenos extracelulares (como bacterias y hongos). Otros linfocitos T CD4 colaboran con los linfocitos B en la producción de Ac o tienen funciones regulatorias, como los linfocitos T reguladores o Treg.
Inmunosenescencia
Igual que el resto del organismo, el sistema inmunitario también envejece2. Se emplea el término inmunosenescencia para designar el deterioro del sistema inmunitario provocado por el envejecimiento. La inmunosenescencia afecta a la defensa contra las infecciones, que siguen siendo la principal causa de muerte en los ancianos. Además, la vacunación sólo tiene un éxito parcial en individuos de edades avanzadas3. La respuesta a algunas vacunas, como la de la hepatitis B, comienza a declinar a partir de los 40 años. A los 50 comienza la reactivación de virus latentes, como el virus de varicela zoster (VZV), y se incrementa significativamente la morbilidad y mortalidad por la gripe. A partir de la séptima u octava década de la vida se produce un decaimiento abrupto de la inmunidad.
El envejecimiento afecta a todos los elementos de la respuesta inmunitaria, tanto innata como adaptativa, pero hay dos características esenciales que definen la inmunosenescencia: la reducción de los linfocitos T vírgenes y un incremento sostenido de la inflamación. En los ancianos, se produce una disminución del número y variabilidad de los linfocitos T vírgenes, acumulándose linfocitos T de memoria específicos de los patógenos con los que hemos entrado en contacto previamente, por lo que la capacidad de responder a nuevos patógenos se va reduciendo. La pandemia causada por la infección por SARS-CoV-2 nos muestra las consecuencias de la aparición de un nuevo patógeno frente al que no tenemos memoria previa. Los individuos ancianos que ya no dispongan de un repertorio suficientemente variado de linfocitos T vírgenes serán menos eficaces en eliminar el virus y tendrán más riesgo de sufrir una forma más grave de la enfermedad. La inmunosenescencia también se asocia a un incremento sostenido de la inflamación, que actúa de acelerador de muchas patologías crónicas asociadas al envejecimiento, como la diabetes tipo 2, las enfermedades cardiovasculares o neurodegenerativas.
Respuesta innata
El envejecimiento reduce las barreras físicas formadas por la piel y las mucosas que nos aíslan del exterior, incrementando el riesgo de sufrir infecciones4,5. Igualmente, decae la inmunidad innata, aunque no de forma tan pronunciada como la adaptativa, puesto que incluso algunos elementos de la respuesta innata se pueden incrementar con la edad. La capacidad de renovación de las células madre hematopoyéticas, así como la hematopoyesis disminuyen con la edad. Sin embargo, existe una desviación hacia los progenitores mieloides y hacia la producción de células mieloides encargadas de la respuesta innata en comparación con los linajes linfoides, que decaen de una forma más pronunciada. Como consecuencia, el número de neutrófilos y de monocitos-macrófagos no disminuye con la edad2, aunque su funcionalidad sí se ve disminuida. La capacidad quimiotáctica y fagocítica de los neutrófilos se reduce, retrasando su infiltración del foco infeccioso6, lo que afecta negativamente a su capacidad para controlar infecciones bacterianas y hongos extracelulares. Igualmente, el número de monocitos-macrófagos en los ancianos es comparable a individuos jóvenes, pero su capacidad fagocítica está disminuida7, existiendo una polarización hacia la producción de citocinas inflamatorias (Tabla 1).
Inmunosenescencia
- Disminución de la capacidad quimiotáctica y fagocítica de macrófagos y neutrófilos
- Incremento crónico de la producción de citocinas y mediadores inflamatorios
- Involución tímica y disminución de la linfopoyesis en la médula ósea
- Disminución del número y variabilidad de linfocitos T y B vírgenes
- Aumento de linfocitos T y B de memoria oligoclonales
- Disminución de la producción de anticuerpos de alta afinidad
- Peor respuesta a la vacunación
- Pérdida de mecanismos inmunoregulatorios y desarrollo de respuestas autoinmunes
Tabla 1. Principales cambios del sistema inmunitario causados por el envejecimiento.
También puede estar reducido en ancianos el número de células dendríticas, así como su capacidad de captación y presentación de Ag a los linfocitos T, lo que va a contribuir a deteriorar, aún más, la inmunidad adaptativa8. Por el contrario, hay un incremento de los niveles de las células NK, aunque su actividad citotóxica puede estar mermada. Diversos estudios proponen que una actividad de células NK preservada puede ser un factor de buena salud y longevidad, mientras que una actividad limitada incrementa el riesgo de infección y muerte9. En individuos centenarios, el número de células NK es comparable a individuos jóvenes (19-36 años).
Inflamación crónica sostenida
Una de las características esenciales asociadas con la inmunosenescencia es la producción continua de mediadores inflamatorios independientemente de la existencia de enfermedades infecciosas agudas (Fig. 1). Incluso en ancianos sanos, los niveles séricos de IL-6 y TNF-α son 2-4 veces mayores que en adultos jóvenes, lo que ha sido asociado con un incremento de su morbilidad y mortalidad. Así, los niveles séricos de TNF-α se correlacionan con un incremento de la mortalidad y los de IL-6 con pérdida de movilidad y discapacidad3. El aumento de IL-6, proteína C reactiva (PCR) y del recuento leucocitario (presumiblemente por un incremento del número de neutrófilos) predispone a la fragilidad en los ancianos. Los niveles de TNF-α e IL-6 también se correlacionan con la pérdida de masa muscular y, eventualmente, con la sarcopenia. Cabe destacar que esta inflamación sostenida no se observa en individuos centenarios, que tienen niveles más bajos de citocinas inflamatorias y niveles aumentados de mediadores anti-inflamatorios, como el cortisol o la IL-10, en comparación con individuos de 70-80 años. En conjunto, la respuesta inflamatoria sostenida que se observa en individuos ancianos es perjudicial para la longevidad.
Las células innatas y, más concretamente, los macrófagos son las principales productoras de mediadores inflamatorios. Las causas del aumento de su producción sostenida son múltiples y algunas no bien conocidas3. Uno de los principales responsables de la inflamación es la persistencia de infecciones virales crónicas por virus latentes, como el Epstein Barr Virus (EBV) o el citomegalovirus (CMV), como explicaremos más adelante. La eliminación incompleta e ineficiente de estos virus supone un estímulo antigénico constante que activa la respuesta inmunológica. También contribuyen a la inflamación las alteraciones endocrinas y la disminución del efecto barrera de la mucosa gastro-intestinal que dificulta el control de la microbiota. Igualmente, la atenuación de la respuesta adaptativa y la disminución del número de linfocitos reduce la homeostasis inmunológica. No obstante, las células inmunitarias no son las únicas responsables de este fenómeno. La senescencia celular y el daño persistente al ADN, característico de la senescencia, inicia un programa transcripcional que promueve la secreción de numerosas citocinas inflamatorias, lo que se conoce como un fenotipo secretorio asociado a la senescencia (senescence-associate secretory phenotype o SASP).
La inflamación crónica es un agravante de patologías asociadas con el envejecimiento, como la arteriosclerosis, ciertas enfermedades neurodegenerativas (como la enfermedad de Alzheimer) y autoinmunes, la osteoporosis o el cáncer (Fig. 1). Además, las enfermedades inflamatorias crónicas provocan alteraciones en el sistema inmunitario que aceleran la inmunosenescencia en individuos jóvenes, demostrando que no es un proceso exclusivo de los ancianos.
Linfocitos T e inmunosenescencia
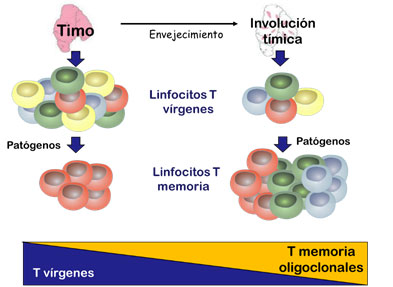
El envejecimiento afecta fundamentalmente al compartimento de los linfocitos T y se manifiesta como la disminución progresiva del número y variabilidad de los mismos, principalmente a costa de los linfocitos T vírgenes (CD95-). Este proceso se acelera a partir de los 70-75 años y es especialmente marcado en la reducción de los linfocitos T CD8, lo que afecta de forma más pronunciada a la respuesta inmune contra virus. Los linfocitos T CD4 disminuyen de forma más moderada con la edad. De hecho, la inversión del ratio CD4:CD8 es un buen marcador de la disfunción inmunológica del individuo y se asocia con mayor mortalidad.
La disminución de los linfocitos T se debe en gran medida a la involución tímica. En los primeros años de vida se genera una gran cantidad de linfocitos T vírgenes. Sin embargo, el timo comienza a atrofiarse temprano, a partir de la pubertad, frenando la producción de linfocitos T, que llega a ser casi inexistente al final de la 6ª década de la vida (Fig. 2). La disminución de linfocitos T vírgenes se debe también a la interacción con diversos patógenos a lo largo de la vida. Esta exposición va incrementando el número de linfocitos T de memoria oligoclonales específicos frente a estas infecciones (inmunobiografía). De esta manera la población de linfocitos T vírgenes, que tienen un papel esencial en la protección contra nuevos patógenos, es máxima en la infancia y adolescencia, mientras que los linfocitos T de memoria para los patógenos locales tiene mayor representación en edades avanzadas. La estimulación antigénica repetida a lo largo de la vida y la falta de recambio de linfocitos T vírgenes acaba promoviendo en los ancianos la aparición de linfocitos T senescentes y disfuncionales, sobre todo linfocitos T CD8, caracterizados por telómeros cada vez más cortos y por la ausencia de expresión de la molécula coestimuladora CD28.
Este proceso de diferenciación terminal de los linfocitos T con la edad se acelera en aquellos individuos que sufren infecciones crónicas por virus latentes, como el CMV10. La infección por CMV se adquiere durante toda la vida, afectando al 30% de los individuos de 20 años y al 90-100% de los ancianos. La estimulación crónica por este virus produce una expansión de los linfocitos T CD8+CD28- específicos que pueden incluso llegar a representar hasta el 50% del total de linfocitos T CD8 de un individuo (los linfocitos T CD4 también se expanden, pero en menor medida). La expansión de estos linfocitos T CD8+CD28- específicos del CMV acelera aún más la disminución del compartimento de linfocitos T vírgenes y de memoria funcionales. Además, estos linfocitos producen mayoritariamente citocinas inflamatorias (IL-1, IL-6, TNF-α, IFN-γ), contribuyendo al aumento de la inflamación crónica con la edad que explicamos anteriormente.
Los cambios que se producen en los linfocitos B con la edad son similares a los que ocurren en los linfocitos T. Por un lado, disminuye progresivamente el número de linfocitos B, especialmente a costa de los linfocitos B vírgenes, debido a la disminución de la linfopoyesis en la médula ósea. Por el contrario, aumentan los linfocitos B de memoria específicos de los patógenos con los que hemos entrado en contacto previamente. Consecuentemente, hay una disminución de Ig producidas por los linfocitos B vírgenes, pero hay un aumento de IgG e IgA producidas por linfocitos B efectores/memoria7. No obstante, la calidad de la respuesta humoral también se resiente debido tanto a la pérdida de capacidad de los linfocitos T CD4 de colaborar con los linfocitos B, como al propio deterioro de los linfocitos B6. Esto limita el cambio de isotipo y maduración de la afinidad y disminuye la producción de Ac de alta afinidad contra nuevos patógenos. Asimismo, se observa un incremento de la producción de auto-Ac, indicando que los mecanismos de tolerancia (eliminación o inactivación de los linfocitos B autorreactivos) son defectuosos en ancianos.
Por tanto, los motivos principales del deterioro de la respuesta adaptativa son la involución tímica y la disminución de la linfopoyesis en la médula ósea. Además, la edad induce la senescencia de los linfocitos debido al acortamiento de los telómeros y a la acumulación de daños en su ADN. La senescencia es especialmente relevante en los linfocitos debido a que la capacidad de la telomerasa de reparar los telómeros disminuye con la edad y la diferenciación celular. En conjunto, los cambios producidos en el compartimento de linfocitos B y T en los ancianos dificulta la capacidad de producir una respuesta inmunitaria eficaz contra nuevas infecciones y la capacidad de generar memoria inmunológica con las vacunas. La fragilidad en los ancianos también puede estar asociada al descenso de la respuesta humoral.
Consecuencias clínicas de la inmunosenescencia
La consecuencia más obvia y grave de la inmunosenescencia es el incremento de la susceptibilidad a las infecciones, siendo muy frecuentes en ancianos aquellas que afectan a las vías respiratorias altas, causadas por bacterias extracelulares capsuladas (ej. neumococo), y las infecciones urinarias. Como comentamos anteriormente, la inmunosenescencia también dificulta la respuesta a nuevos virus que no nos han infectado en el pasado, como es el caso del SARS-CoV-2, e incrementa la reactivación de infecciones por algunos virus latentes, como el virus varicela zóster (VZV). Sin embargo, la reactivación de infecciones persistentes por CMV son raramente observadas.
Con la edad también decae la eficacia de la vacunación y aumentan sus riesgos11. Una primera vacunación con virus vivos atenuados, como la fiebre amarilla, incrementa significativamente la morbilidad y la mortalidad en ancianos. Aunque las vacunas contra el neumococo, gripe o VZV están recomendadas en ancianos, su eficacia está limitada y no es satisfactoria12.
La inmunosenescencia también predispone al desarrollo de diversas patologías. La disminución de la inmunovigilancia mediada, sobre todo, por los linfocitos T incrementa el riesgo de desarrollar un cáncer. También aumenta el riesgo de sufrir algunas manifestaciones autoinmunes, a pesar de que los linfocitos T reguladores no parecen estar reducidos ni llamativamente afectados con la edad. Sin embargo, en conjunto, los mecanismos de tolerancia inmunológica decaen con el envejecimiento. Un bajo nivel de auto-Ac es común, incluso en ancianos sanos, y predispone al desarrollo de ciertas enfermedades autoinmunes, como la artritis reumatoide, que suele debutar en adultos de mediana edad y cuya incidencia se incrementa con el paso de los años.
Intervenciones para retrasar o limitar la inmunosenescencia
No todos los individuos envejecen igual, ni física ni inmunológicamente. Los individuos centenarios mantienen un buen funcionamiento de su sistema inmunitario, no presentan una elevada inmunosenescencia, ni inflamación crónica y tienen generalmente menor deterioro inmunitario que la población de entre 70 y 80 años. Es esencial detectar marcadores genéticos, moleculares y/o inmunológicos que identifiquen tempranamente a individuos de riesgo con el fin de realizar intervenciones específicamente diseñadas para retrasar la inmunosenescencia. La inversión del ratio CD4:CD8, el incremento de linfocitos T CD8+CD28-, el aumento de citocinas inflamatorias, como la IL-6, la disminución del número de linfocitos B y la seropositividad para CMV son marcadores de inmunosenescencia comúnmente aceptados en la actualidad7.
La investigación de terapias encaminadas a retrasar la inmunosenescencia es un campo creciente de interés científico. Una de las dianas más estudiadas para reducir la inmunosenescencia es el incremento de la actividad telomerasa de los linfocitos. Los pacientes con infección crónica por VIH acumulan linfocitos T CD8 con telómeros acortados y constituyen un buen modelo de estudio. De hecho, muestras de sangre de estos individuos se han empleado para determinar la eficacia del uso de terapia génica para expresar el gen de la telomerasa (hTERT) o de activadores farmacológicos de dicha proteína (TAT2) de incrementar la respuesta inmune13. Otra alternativa terapéutica es el reemplazo de linfocitos T senescentes mediante trasferencia adoptiva de linfocitos T efectores, una estrategia que ha demostrado su eficacia en la eliminación de infecciones latentes por CMV14. Asimismo, algunas citocinas u hormonas, como IL-7, FGF7, GH o IGF-1, podrían rejuvenecer el timo y mejorar la producción de linfocitos T vírgenes, aunque su administración podría incrementar el riesgo de desarrollar enfermedades autoinmunes o cáncer. Por ello, es necesario realizar ensayos clínicos específicos para contraponer los riesgos y beneficios que pueden producir estas terapias.
Mientras esperamos que algunos de estos posibles avances científicos puedan en el futuro mejorar la salud inmunológica de los ancianos, hoy en día existen algunas intervenciones que pueden ayudar a limitar estos procesos y permitir alcanzar un envejecimiento saludable. Estrategias sencillas que se pueden implementar para reducir o retrasar la inmunosenescencia son, en muchos casos, las mismas que nos ayudan a llevar una vida saludable y a reducir el riesgo de las enfermedades crónicas previamente mencionadas, como las enfermedades cardiovasculares. Por ejemplo, la restricción calórica disminuye la producción de mediadores inflamatorios y revierte parte de los efectos de la inmunosenescencia sobre las células inmunes15. La actividad física ha demostrado efectos beneficiosos contrarrestando la pérdida de masa muscular y favoreciendo el mantenimiento de una adecuada respuesta inmunológica. De hecho, un amplio meta-análisis realizado recientemente muestra que la actividad física moderada o vigorosa reduce un 37% la mortalidad causada por infecciones comunitarias, aumenta el número de linfocitos T CD4, los niveles de IgA salival y la producción de Ac en respuesta a la vacunación, mientras que disminuye el número de neutrófilos16. Los mecanismos implicados son desconocidos y probablemente multifactoriales, pero se ha descrito recientemente que la estimulación mecánica de los huesos, por ejemplo, por el movimiento, activa mecanoreceptores expresados en progenitores óseos favoreciendo la formación ósea y la liberación de stem cell factor (SCF) que estimula la linfopoyesis17. A nivel clínico, el desarrollo de medicamentos anti-inflamatorios de baja toxicidad es una idea interesante que podría reducir la inflamación crónica en ancianos. Medicamentos con funciones anti-inflamatorias, como la aspirina o las estatinas, han sido usadas rutinariamente para prevenir enfermedades cardiovasculares. El desarrollo de medicamentos anti-inflamatorios de baja toxicidad podría ser una alternativa para disminuir la inflamación crónica.
Mejorar la respuesta a las vacunas en ancianos es otra intervención factible y esencial12, ya que, a pesar de que ciertas vacunas, como la del neumococo, la gripe o el VZV, están recomendadas para ancianos, su eficacia no es satisfactoria. El título de Ac contra el tétanos decae a partir de los 50 años, por lo que dosis de refuerzo de la vacuna del tétanos deberían darse a intervalos de 10 años. De forma similar, muchos ancianos también muestran una protección incompleta contra la difteria, por lo que una dosis de refuerzo de la vacuna acelular contra la difteria debería ser considerada para individuos de más de 65 años. Debe también considerarse la vacunación contra la hepatitis A y B. Además, es necesario identificar nuevas formas de producir vacunas, así como nuevos protocolos de vacunación adaptados específicamente a las características inmunológicas de los ancianos. Por ejemplo, las vacunas de ARN empleadas para prevenir la COVID-19 han mostrado una alta efectividad, incluso en individuos mayores de 65 años. Pueden existir mejores adyuvantes específicos para los ancianos que las sales de aluminio. En ensayos clínicos los agonistas de TLR9 mejoran significativamente la eficacia de la vacunación en la hepatitis B. También se deben ajustar las dosis de las vacunas en los ancianos. Por ejemplo, altas dosis de la vacuna de la gripe han mostrado ser más eficaces respecto a las dosis estándar18. La dosis de la vacuna de VZV usada en ancianos es 14 veces mayor que la que se usa en niños. La principal causa de muerte en los ancianos sigue siendo las infecciones lo que nos indica claramente que todavía tenemos mucho camino por recorrer en este campo.
El objetivo principal de estas intervenciones es mantener nuestro sistema inmunitario en buenas condiciones, lo que no sólo nos ayudará a tener una vida más longeva, sino también a envejecer con salud y, por consiguiente, con una mejor calidad de vida.
Agradecimientos
Este artículo está financiado por el Proyecto del Instituto de Salud Carlos III (PI19/01353) y los fondos FEDER de la Unión Europea. CSB tiene una beca Severo Ochoa Grant (BP19-066).
Referencias
- Regueiro González JR. Inmunología : biología y patología del sistema inmunitario. 4* ed. Madrid: Panamericana; 2013.
- Valiathan R, Ashman M, Asthana D. Effects of Ageing on the Immune System: Infants to Elderly. Scand J Immunol. 2016;83(4):255-266.
- Rich RR. Clinical immunology : principles and practice. 3rd ed. Philadelphia: Mosby Elsevier; 2008.
- Nomellini V, Gomez CR, Kovacs EJ. Aging and impairment of innate immunity. Contrib Microbiol. 2008;15:188-205.
- De Martinis M, Sirufo MM, Ginaldi L. Allergy and Aging: An Old/New Emerging Health Issue. Aging Dis. 2017;8(2):162-175.
- Fali T, Vallet H, Sauce D. Impact of stress on aged immune system compartments: Overview from fundamental to clinical data. Exp Gerontol. 2018;105:19-26.
- Ventura MT, Casciaro M, Gangemi S, Buquicchio R. Immunosenescence in aging: between immune cells depletion and cytokines up-regulation. Clin Mol Allergy. 2017;15:21.
- Simon AK, Hollander GA, McMichael A. Evolution of the immune system in humans from infancy to old age. Proc Biol Sci. 2015;282(1821):20143085.
- Muller L, Fulop T, Pawelec G. Immunosenescence in vertebrates and invertebrates. Immun Ageing. 2013;10(1):12.
- Pawelec G, McElhaney JE, Aiello AE, Derhovanessian E. The impact of CMV infection on survival in older humans. Curr Opin Immunol. 2012;24(4):507-511.
- Pawelec G. Age and immunity: What is "immunosenescence"? Exp Gerontol. 2018;105:4-9.
- Ciabattini A, Nardini C, Santoro F, Garagnani P, Franceschi C, Medaglini D. Vaccination in the elderly: The challenge of immune changes with aging. Semin Immunol. 2018;40:83-94.
- Dagarag M, Evazyan T, Rao N, Effros RB. Genetic manipulation of telomerase in HIV-specific CD8+ T cells: enhanced antiviral functions accompany the increased proliferative potential and telomere length stabilization. J Immunol. 2004;173(10):6303-6311.
- O'Reilly RJ, Doubrovina E, Trivedi D, Hasan A, Kollen W, Koehne G. Adoptive transfer of antigen-specific T-cells of donor type for immunotherapy of viral infections following allogeneic hematopoietic cell transplants. Immunol Res. 2007;38(1-3):237-250.
- Ma S, Sun S, Geng L, et al. Caloric Restriction Reprograms the Single-Cell Transcriptional Landscape of Rattus Norvegicus Aging. Cell. 2020;180(5):984-1001 e1022.
- Chastin SFM, Abaraogu U, Bourgois JG, et al. Effects of Regular Physical Activity on the Immune System, Vaccination and Risk of Community-Acquired Infectious Disease in the General Population: Systematic Review and Meta-Analysis. Sports Med. 2021.
- Shen B, Tasdogan A, Ubellacker JM, et al. A mechanosensitive peri-arteriolar niche for osteogenesis and lymphopoiesis. Nature. 2021;591(7850):438-444.
- DiazGranados CA, Dunning AJ, Kimmel M, et al. Efficacy of high-dose versus standard-dose influenza vaccine in older adults. N Engl J Med. 2014;371(7):635-645.